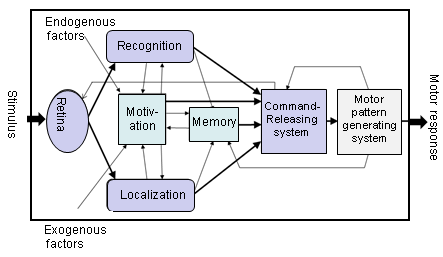
Neurophysiological bases of visually released prey-catching and predator avoidance behaviors in toads: from sign (key) stimulus to releasing mechanism _______ Neurophysiologische Grundlagen für die visuelle Auslösung des Beutefang- und Fluchtverhaltens bei Kröten: vom Signall(Schlüssel)-Reiz zum Auslöse-Mechanismus .
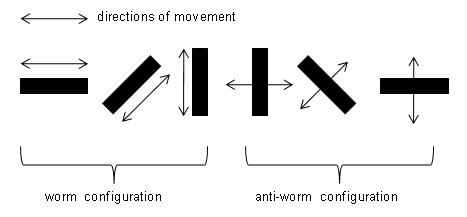
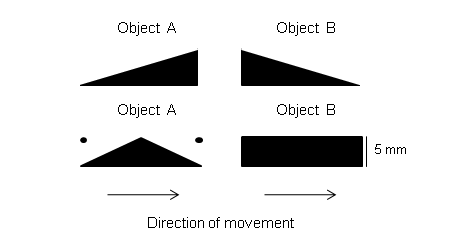
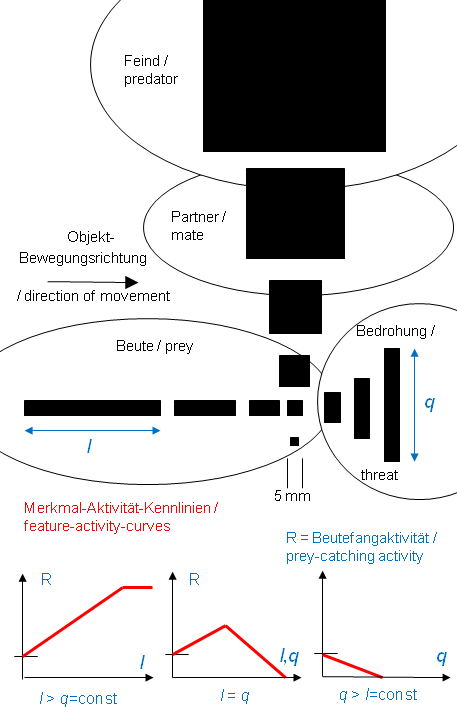
Fig.1. Influence of three modes of systematic changes in figural features – l or q, l and q – of two-dimensional black objects moving at constant velocity against a white backgrund on the prey-catching orienting activity in the common toad Bufo bufo. Each object circled around the toad in the horizontal plane. R= number of orienting responses during the presentation of a stimulus, e.g., 1 min. The Figure shows that the features l and q – depending on amount and proportion – yield different signals to the toad [1] . Abb.1. Einfluss von drei Arten systematischer Veränderung figuraler Merkmale – l oder q, l und q – von zweidimensionalen schwarzen vor weißem Hintergrund mit konstanter Geschwindigkeit bewegten Objekten auf die Beutefang-Wendeaktivität der Erdkröte Bufo bufo. Jedes Object kreiste um die Kröte in der Horizontalebene. R= Anzahl der Wendebewegungen während der Darbiertung eines Stimulus, z.B. 1 min. Die Abbildung zeigt, dass die Merkmalen l und q – je nach Betrag und Verhältnis – für die Kröte unterschiedliche Signalwirkung haben [1] . . Summary of research data by J.-P. Ewert and coworkers–) >>Weblinks [1] - [82] lead to the relevant research papers, most with abstracts<< Different aspects of toad vision are illustrated in: http://www.joerg-peter-ewert.de/13.html see also LectureNotes Block 12 #5-13 Approach Animals see things and then react on the basis of what they see, provided the motivation is appropriate. What chain of events connects some key stimulus with a specific pattern of response? In the recent decades neuroethologists in several laboratories have thought by very different means to analyze the neural mechanisms by which animals interpret sensory signals and select the appopriate response. The most effective way to understand the neural basis of behavior appears to be to apply a broad spectrum of experimental techniques: to combine ethological studies of an animal's behavior with experiments involving brain anatomy, mapping of the local cerebral glucose utilization, brain cell stimulation, recording of individual nerve cell activity, neurochemical studies, brain lesion techniques, etc. [15] . Beginning in the early 60s, Ewert and coworkers studied the question of visual releasers of prey-catching and predator avoidance behaviors in toads first from a behavioral view point that regards the toad’s brain as a „black box“ that transforms selected visual information into appropriate action patterns [1]. Since prey catching and avoidance responses are easily counted, it is feasible to measure the relative effectiveness of dummy prey- or enemy objects, when stimulus parameters such as size or configuration, velocity (direction,pattern) of motion, and brightness (direction of contrast) are systematically varied. From an extensive tabulation of such quantitative data it is further possible to compute feature-activity-curves in terms of algebraic equations that define the effect of a particular parameter on the frequency of prey catching and predator avoidance responses. Thus, without any reference to the actual processes at work within the visual system, one can give an abstract description of the toad’s behavior in terms of a number of „transformations“. Such quantitative description of visuomotor transformations will then guide the study of particular parts of the visual system – retinofugal fibers, retinorecipient tectal and pretectal units – in order to determine their individual input-output functions and to investigate modulating/modifying/specifying influences as well as sensorimotor access.
Functional components of a "black box" mediating between visual stimulus and motor response.
In focus is the question: What neurons or sets of neurons and what spatiotemporal firing patterns of activity are necessary or sufficient to accomplish recognition of behaviorally significant visual sign stimuli and initiation of behavioral reaction? There are two main concepts (cf. Ewert 1997; Bullock 1999): · The parallel-distributed spatiotemporal pattern concept suggests that perception and action, generally, result from distributed assembladges of huge numbers of neurons firing in characteristic patterns in space and time. The problem is by whom and – if known – how the specific pattern in space and time is read. · The convergence concept suggests that processing streams, computing the features of a visual sign stimulus, converge on certain neurons, so that the responses of these neurons become „feature-selective“. Along the axons, they are addressing this message to the corresponding motor pattern generating systems. In the present case study, the validity of these concepts can be tested by investigating the following questions: 1. 1. Do feature-selective neurons exist, i.e. showing best responses toward the sign stimulus that releases the corresponding behavior? 2. 2. Is there a correlation between the discharge pattern of the feature-selective neuron in response to the sign stimulus – recorded in freely moving toads – and the corresponding behavior pattern? 3. 3. Is the discharge pattern of the feature-selective neuron towards the sign stimulus state-dependent, i.e. does the pattern change if the toad is inattentive (not responsive) to the sign stimulus, occasionally? 4. 4. Can the behavior be released by focal electrical stimulation of an area harboring the feature-selective cells? 5. 5. In case that the neurons‘ feature selectivity is altered experimentally (e.g., by elimination of a significant input), does the behavior change in its feature selectivity accordingly? If the five questions can be positively answered, the concept dealing with converging neuronal activities should be preferred in favor of a concept dealing with distributed neuronal activities. The feature-selective neuron in question participates significantly in behavioral recognition. Themes 1).Key stimuli: feature-activity-curves; 2).Head preference phenomenon; 3).Invariance; 4).Species-specificity; 5).Comparison of behavioral and neuronal feature-activity-curves; 6).Prey-selective tectal neurons; 7).Tectal functions; 8).Threat-sensitive pretectal neurons; 9).Pretectal influences; 10).Pretectal functions; 11).Telencephalic control of pretectum; 12).Learning; 13).Conserved connections; 14).Releasing mechanism/system; 15).Triggering prey-catching; 16).Background texture; 17).Size constancy phenomenon; 18).Integration of vision and touch; 19).Implicit vs. explicit computation; 20).Phylogenetic aspects; 21).Modeling and neural engineering; 22).Historical background. 1) Key stimulus: feature-activity-curves The visual system of amphibians is primarily focused on the perception of moving objects. During prey-catching behavior, toads exhibit the ability to select moving objects under different figural characteristics: object extension along the direction of movement – within limits – signals prey; extension transversely to the direction of movement indicates non-prey [1] . The ratio of the features { longitudinal, l } to { transverse, q } is a criterion for opening up the "category prey" and to separate it from "unpalatable" or "threat" (see Figure 1, above). The boundary of the prey category depends, e.g., on the toad’s motivation. (During the mating season, toad's movement perception is focused primarily on mates, the sexual partners, whose sizes are "intermediate" between large prey and small predator stimuli. During mating motivation the thresholds for prey-catching or predator-avoidance, respectively, are rather high). __________ Das visuelle System der Amphibien ist primär auf die Wahrnehmung von bewegten Objekten ausgerichtet. Erdkröten besitzen die Fähigkeit, beim Beutefang bewegte Objekte aufgrund figuraler Merkmale zu unterscheiden: Objektausdehnung längs der Bewegungsrichtung – in Grenzen – signalisiert Beute; Ausdehnung quer zur Bewegungsrichtung signalisiert Nichtbeute [1] . Das Verhältnis der Merkmale { Längsausdehnung, l } zu {Querausdehnung, q } bildet ein Kriterium dafür, die “Kategorie Beute“ figural zu erschließen und sie gegenüber “Ungenießbarem” bzw. “Bedrohlichem“ figural abzugrenzen (s. Fig.1). Die Grenze hängt u.a. von der Motivation der Kröte ab. (Während der Paarungszeit steht das Bewegungssehen der Kröten vorwiegend im Dienste der Orientierung zum sexuellen Partner, dessen Größe zwischen derjenigen großer Beute und kleiner Feindobjekte liegt. Während der Paarungsmotivation liegen die Schwellen für Beutefang bzw. Fluchtverhalten relativ hoch.) Der Begriff figuraler Beute-Schlüsselreiz bezieht sich im vorliegenden Zusammenhang daher nicht auf ein bestimmtes Objekt (z..B. Wurm), sondern auf eine Objekt-Kategorie: alle potenziellen Beutetiere mit relativ kleiner Querausdehnung, die sich in Richtung ihrer Körperlängsachse bewegen, also Käfer, Asseln, Würmer, Tausendfüßer etc. Damit ist der Begriff Schlüsselreiz nicht obsolet, sondern –für diese Fallstudie– operational definiert und damit präzisiert. Der Schlüssel bezeichnet den Algorithmus, der die Merkmale Längsausdehnung und Querausdehnung aufeinander bezieht und dadurch die figurale Signalwelt „Beute“ erschließt. Der Zusammenhang dieser Merkmale für die Beutefangauslösung ist experimentell messbar [2] und anhand von entsprechenden Merkmal-Aktivität-Kennlinien quantifizierbar (s. Abb. 1). Diese Kennlinien zeigen die Abhängigkeit der Beutefangaktivität von der Änderung eines Merkmals: l, q bzw. l und q für l=q. 2) Head preference phenomenon Figure 1 (from left to right) shows the continuous change of figural features of stripes while passing prey characteristics (l > q) to threat characteristics (q > l). The maximum figural contrast is represented by stripes toward the ends of the feature continua: a stripe whose longitudinal axis is oriented parallel to the direction of movement (in laboratory jargon: "worm" configuration) compared to the same stripe format whose long axis is oriented transversely to the direction of movement ( "anti-worm" configuration). In response to objects in worm configuration toads display yet another characteristic of figural feature detection: to a black stripe moving wormlike against a white background they orient and snap toward the edge leading in the direction of movement. This "head preference" is independent of the direction of motion [65] . __________ Abbildung 1 (von links nach rechts) zeigt die kontinuierliche Veränderung figuraler Merkmale streifenförmiger Objekte, wobei Beute-Merkmale (l > q) in Droh-Merkmale (q > l) übergehen. Der maximale figurale Kontrast wird repräsentiert durch Streifen jeweils am Ende der Merkmals-Kontinua: ein Streifen, dessen Längsachse parallel zur Bewegungsrichtung orientiert ist (im Laborjargon: „Wurm“ Konfiguration) gegenüber demselben Streifenformat, dessen Längsachse quer zur Bewegungsrichtung orientiert ist („Antiwurm“ Konfiguration). Gegenüber Objekten in Wurm-Konfiguration zeigen Erdkröten noch ein weiteres Phänomen figuraler Merkmalsdetektion: auf einen schwarzen vor weißem Hintergrund wurmförmig bewegten Streifen wenden sie sich und schnappen sie nach dem in Bewegungsrichtung weisenden Streifenende. Diese „Kopfpräferenz“ ist unabhängig von der Bewegungsrichtung [65] . 3) Invariance The discrimination of the figural features (Fig.1) is invariant with respect to changes in other stimulus parameters, e.g. the pattern of motion [5] and the direction of movement of an object in the x-y-z coordinates [3] [4], as appropriate experimental arrangements have shown. This means, for example, that a horizontally oriented stripe displays worm configuration when it is moved in a horizontal direction; moving in a vertical direction this stripe displays anti-worm configuration, etc.
If the direction in the stimulus-background-contrast is changed – black objects against a white background [b/w] compared to white objects against a black background [w/s] – the toad’s figural detection is confined. Although the feature-activity-curves shown in Fig.1, in principle, also apply for [w/b], the acuity of figural discriminaten, however, is weaker [66] . The "head preference" in response to a wormlike moving stripe – obtained at [b/w] – is inverted by reversing the direction of the contrast at [w/b] to "tail preference" (orienting and snapping towards the trailing edge) [65] . This phenomenon can be evaluated in different ways. Ethologically, the efficiency of the toad’s prey-catching behavior depends on the contrast direction of the wormlike stripe; head preference assures success but tail preference does not because the toad usually snaps behind the stripe. Neurophysiologically, the releasing target is an off-effect, whose locus changes under a change in the direction of the contrast: it occurs toward the leading edge in the [b/w] stripe and toward the trailing edge at the [w/s] stripe. __________ Die Unterscheidung der figuralen Merkmale gemäß Abb.1 ist invariant gegenüber Veränderungen anderer Reizparameter, z.B. dem Bewegungsmuster [5] und der Bewegungsrichtung eines Objekts in den x-y-z Raumkoordinaten [3] [4], wie Tests mit entsprechenden Versuchsanordnungen ergeben haben. Das bedeutet z.B.: ein horizontal orientierter Streifen besitzt Wurm-Konfiguration, wenn er in horizontaler Richtung bewegt wird; in vertikaler Richtung bewegt hat dieser Streifen Antiwurm-Konfiguration, etc. Wird die Richtung des Reiz-Hintergrund-Kontrasts verändert – schwarzes Objekt vor weißem Hintergrund [s/w] gegenüber weißem Objekt vor schwarzem Hintergrund [w/s] – , so ist die Merkmals-Detektion eingeschränkt. Zwar gelten die in Abb.1 gezeigten Merkmal-Aktivität-Kennlinien im Prinzip auch für [w/s], allerdings ist die Schärfe der figuralen Merkmals-Unterscheidung der Kröte für [w/s] schwächer als für [s/w] [66] . Die „Kopfpräferenz“ für bewegte Streifen wird durch Umkehr der Kontrast-Richtung von [s/w] zu [w/s] in „Schwanzpräferenz“ invertiert (Zuwendung und Schnappen nach dem hinteren Ende) [65] . Dieses Phänomen kann unterschiedlich bewertet werden. Ethologisch betrachtet ist die Effizienz des Beutefangs der Kröte von der Kontrastrichtung abhängig: Kopfpräferenz beim Beutefang ist erfolgversprechend, Schwanzpräferenz dagegen nicht, denn die Kröte schnappt meist an dem Streifenende vorbei. Sinnesphysiologisch betrachtet ist das auslösende Ziel für beide Kontrastrichtungen dasselbe, nämlich ein off-Effekt; dieser ist ortsabhängig: er tritt bei [s/w]-Streifen an der Vorderkante und bei [w/s]-Streifen an der hinteren Kante auf. 4) Species specificity The principle of figural feature discrimination (prey selectivity) is adapted to terrestrial life [6] [7]. It does not occur in the tadpole stage (tadpoles of toads are vegetarians), it is present after metamorphosis (without prey-catching experience) [8], it matures in ontogeny and it is typical for the representatives Bufo bufo, i.e. species-specific [9]. The principle is common to all terrestrial anurans in species-specific expression. It occurs most clearly in the common toad (Bufo bufo L.) and weakest in water frogs (Rana esculenta L.). __________ Das Prinzip der figuralen Merkmalsunterscheidung (Beuteselektivität) ist an terrestrische Lebensweise angepasst [6] [7] . Es tritt im Kaulquappen-Stadium nicht auf (Erdkröten-Kaulquappen ernähren sich vegetarisch), es ist nach der Metamorphose mit dem Übergang zum Leben an Land präsent, ohne dass Beutefangerfahrungen erforderlich wären [8] , es reift in der Ontogenese und ist für die Vertreter der Spezies Bufo bufo typisch, d.h. spezies-spezifisch [9] . Das Prinzip tritt bei allen untersuchten terrestrischen Anuren auf, und zwar in spezies-spezifischer Ausprägung. Am deutlichsten ist es ausgeprägt bei Erdkröten (Bufo bufo L.) und am schwächsten bei Wasserfröschen (Rana esculenta L.). 5) Comparison between behavioral and neuronal feature-activity-curves Seeking the neuronal basis of figural prey selectivity, the feature-activity-curves of prey-catching are compared with the corresponding feature-activity-curves of neurons of the visual system: retinal ganglion cells and retinorecipient neurons of the optic tectum and the pretectal thalamus (neuronal activity measured in terms of discharge frequency [impulses per sec]). The contrast direction depending head vs. tail preference to a wormlike moving stripe measured in toad’s snapping behavior is best reflected by the responses of tectal prey-selective neurons [67] . Since this phenomenon is to some extent resembled in the responses by off-dominated retinal on-off ganglion cells (class R3), it is suggested that R3 neuronal output (cf. Fig.7) contributes to the detection of a moving contrast border (see also [68] ). __________ Maßgeblich für die Untersuchung neuronaler Grundlagen der figuralen Beuteselektivität ist ein Vergleich der für den Beutefang ermittelten Merkmal-Reaktion-Kennlinien mit entsprechenden Kennlinien für Neurone des visuellen Systems: retinale Ganglienzellen sowie retinarezipiente praetectale und tectale Neurone (neuronale Aktivität gemessen als Entladungsfrequenz [Impulse pro sec]). Die Kennlinien der figuralen Beuteselektivität gemessen im Beutefangverhalten finden ihr Abbild in entsprechenden Kennlinien von bestimmten Neuronentypen des Tectum opticum [14] [15] [16] [17] [18] – genannt "Beutedetektoren" oder "beuteselektive Neurone", Typ T5.2 –, nicht dagegen in den Kennlinien von retinalen Ganglienzellen [19] . Die von der Kontrastrichtung abhängige Kopf / Schwanz Präferenz gegenüber einem wurmförmig bewegten Streifen, wie im Schnappverhalten der Kröte gemessen, wird am besten in den Antworten von tectalen beuteselektiven Neuronen reflektiert [67]. Da dieses Phänomen teilweise auch in den Antworten von off-betonten retinalen on-off Ganglienzellen (Klasse R3) zur Geltung kommt, liegt die Vermutung nahe, dass Ausgänge von R3 Neuronen (Abb.7) zur Detektion bewegter Kontrastgrenzen beitragen (vgl. auch [68]). 6) Prey-selective tectal neurons – recordings in freely moving toads . The ultimate proof of a correlation between the response of prey-selective tectal neurons (type T5.2) and prey-catching behavior was provided by recordings in freely moving toads, applying an advanced method [72] [73] vs. the former one [74]: · Experiment-1. A wormlike moving stripe (cf. Fig.1) entered the neuron’s receptive field located laterally in the visual field: the neuron’s discharge rate increased strongly in a manner of a „warming-up“; shortly after its peak, the toad started orienting towards the prey stimulus; the neuron fired moderately during the orienting response (cf. Fig.2 top). · Experiment-2. The receptive field of another neuron of the same type was located frontally in the visual field: toward the wormlike stripe moving nearby the toad, the neuron’s discharge rate showed a brisk increase followed by snapping; during snapping, the neuron immediately stopped firing. [After snapping, the neuron discharged a few spikes indicating that the recording electrode was still in contact to the neuron]. · Experiment-3. The wormlike stripe was replaced by a stripe of the same size presented in anti-worm configuration (Fig.2 middle): the neuron discharged just one or two spikes, while the toad was motionless as it were frozen in its posture. · Experiment-4. Occasionally, the toad was inattentive, i.e. not ready to catch prey: in this case the wormlike stripe elicited merely weak neuronal activity; both neuron’s warming-up and toad’s prey-catching were absent. But the worm vs. anti-worm preference was, below threshold, maintained neuronally also in the toad which was not responsive behaviorally. · Experiment-5. A square object circled around the toad; the size of the square and its distance from the toad, respectively, was varied in different tests: tectal neurons were sensitive to the absolute size, while retinal ganglion cells were sensitive to the visual angular size [73]. [Previous investigations showed that in pharmacologically immobilized awake toads both retinal ganglion cells and tectal neurons were sensitive to the visual angluar size.] · Experiment-6. The pretectal thalamus was lesioned through electrocoagulation deliverd via a second electrode placed ipsilaterally to the recording electrode: in the experimental arrangements like (1)-(4), an extremely strong neuronal burst introduced prey-catching behavior (cf. Fig.2 bottom). The worm vs. anti-worm discrimination and thus prey-detection were abolished. The retina is mapped in mesencephalic and diencephalic projection fields, mainly in the optic tectum and the pretectal thalamus. There is ample evidence showing that in the tectum inhibitory influences of the pretectal thalamus exist and that, for example, the selectivity of tectal prey-selective neurons (type T5.2) is determined by such influences [20] [21] [22] [33] [34] [35]. The neural algorithm [cf. 1)] that weights the figural object features l and q is inherent in distributed parallel retino-tectal and retino-pretectal processing streams, respectively. The features are related to each other through convergence of both processing streams that are interacting in prey-selective tectal cells with opposite arithmetic signs: excitatory (tecto-tectal input) and inhibitory (pretecto-tectal input), respectively. The result is reflected in the response property of prey-selective neurons. After elimination of the pretectal inhibitory input, the prey-selectivity is abolished both neuronally and behaviorally. A note on feature detectors is in order. One might be tempted to call the tectal T5.2 neurons „worm detectors“. However, one should be also aware that these neurons, like toad's prey-capture, are responsive preferably but not exclusively to wormlike moving objects. With respect to the experimental paradigm (cf. Fig.1), these neurons are more likely prey-detectors, since their output is a measure of the probability that a visual stimulus fits the figural prey category determined behaviorally. The term feature detector is appropriate. Focal electrical stimulation of the optic tectum in the layer containing prey-sective neurons elicits prey-catching behavior as if an adequate visual stimulus were present [31]. __________ Den endgültigen Beweis für eine Korrelation zwischen der Aktivität von beuteselektiven Tectum-Neuronen (Typ T5.2) und dem Beutefangverhalten ergaben Ableitungen von freibeweglichen Kröten mittels einer – gegenüber der früheren Methode [74] – weiter entwickelten Technik [72] [73]: · Experiment-1. Ein wurmförmiger Streifen (vgl. Abb.1) wurde in das seitlich im Gesichtsfeld lokalisierte rezeptive Feld bewegt: die neuronale Entladungsrate stieg – vergleichbar einem warming-up Effekt – stark an; kurz nach Erreichen des Maximums reagierte die Kröte mit einer Wendereaktion zum Beute-Stimulus; das Neuron war während der orientierenden Zuwendung mäßig aktiviert (Abb.2 oben). · Experiment-2. Das rezeptive Feld eines anderen Neurons vom gleichen Typ war im frontalen Gesichtsfeld lokalisiert: auf den vor der Kröte bewegten wurmförmigen Streifen antwortete das Neuron mit raschem Anstieg der Entladungsrate, gefolgt von einer Schnappreaktion; mit dem Einsetzen des Schnappens war das Neuron stumm. [Nach dem Schnappen folgten vereinzelt Spikes, die zeigten, dass sich die Ableitelektrode gegenüber dem Neuron nicht verschoben hatte.] · Experiment-3. Der wurmförmige Streifen wurde gegen einen Streifen derselben Größe in Antiwurm-Konfiguration ausgetauscht (vgl. Abb.2 Mitte): das Neuron antwortete mit ein bis zwei Spikes; die Kröte verhielt sich bewegungslos, sie war sozusagen in ihrer Körperhaltung erstarrt. · Experiment-4. Gelegentlich war die Kröte unaufmerksam, d.h. nicht bereit zum Beutefang: dann bewirkte der wurmförmige Streifen nur schwache Entladungsrate; warming-up des Neurons und Beutefangverhalten der Kröte blieben aus. Die Wurm/Antiwurm-Bevorzugung blieb – unterschwellig – jedoch auf neuronaler Ebene auch bei der nicht reaktionsbereiten Kröte erhalten. · Experiment-5. Ein quadratisches Objekt kreiste um die Kröte; die Größe des Quadrats bzw. dessen Abstand zur Kröte wurde in den jeweiligen Tests variiert: Tectumneuronen waren für die absolute Größe und retinale Ganglienzellen für die Sehwinkelgröße sensitiv [73]. [Frühere Untersuchungen ergaben, dass an pharmakologisch immobilisierten wachen Kröten Tectumneurone und retinale Ganglienzellen beide für die Sehwinkelgröße sensitiv sind]. · Experiment-6. Im praetectalen Thalamus wurde gleichseitig zur Ableitelektrode mit Hilfe einer zweiten Elektrode eine elektrolytische Läsion gesetzt: in den getesteten experimentellen Anordnungen (1)-(4) leitete jeweils ein extrem starker Anstieg der neuronalen Entladungsrate die nachfolgende Beutefangreaktion ein (vgl. Abb.2 unten). Die Wurm/Antiwurm-Unterscheidung und damit die Beute-Detektion waren erloschen. . Die Retina ist in mesencephalen und diencephalen Projektionsfeldern kartiert, hauptsächlich im Tectum opticum und im praetectalen Thalamus. Es gibt zahlreiche Beweise dafür, dass es im Tectum inhibitorische Einflüsse aus dem praetectalen Thalamus gibt, und dass z.B. die Selektivität von tectalen Beute-selektiven Neuronen (Typ T5.2) auf solchen Einflüssen beruht [20] [21] [22] [33] [34] [35] . Der neurale Algorithmus [vgl.1)], der die figuralen Objektmerkmale l und q gewichtet, ist inhärent in parallelen retino-tectalen bzw. praetecto-tectalen Verarbeitungsströmen. Diese Merkmale werden zueiander in Beziehung gebracht durch Konvergenz beider Verarbeitungsströme, die mit entgegengesetztem Vorzeichen in tectalen Beute-selektiven Neuronen interagieren: erregend (tecto-tectaler Input) bzw. hemmend (praetecto-tectaler Input). Das Ergebnis spiegelt sich in der Antwortcharakteristik der Beute-selektiven Neurone wider. Nach Ausschaltung des inhibitorischen praetectalen Input erlischt die Beuteselektivität sowohl in der neuronalen Antwort als auch im Beutefangverhalten. Eine Anmerkung zu Merkmals-Detektoren erscheint angebracht. Man könnte die tectalen T5.2 Neurone „Wurm-Detektoren“ nennen. Allerdings muss man bedenken, dass diese Neurone, ähnlich wie die Kröte beim Beutefang (Abb.1), vorzugsweise, jedoch nicht ausschließlich auf wurm-ähnliche bewegte Objekte antworten. Bezogen auf das experimentelle Paradigma (s. Abb.1) handelt es sich bei diesen Neuronen eher um Beute-Detektoren, denn ihr Ausgang ist eine Art Maß für die Wahrscheinlichkeit, dass ein visueller Stimulus – wie im Verhaltensexperiment ermittelt –, in die figurale Beute-Kategorie passt. Die Bezeichnung Merkmals-Detektor ist also angemessen. Lokale Elektrostimulation des Tectum opticum in der Schicht, die beuteselektive Neurone enthält, löst Beutefangverhalten aus, wie wenn ein adäquater visueller Stimulus präsent wäre [31]. 7) Tectal functions The optic tectum is involved in, e.g.:
8) Threat-sensitive pretectal neurons The pretectal thalamus contains types of neurons responding preferentially to large-area visual objects or those with transverse dimensions likely to elicit avoidance or escape behaviors in the toad [29] [30]. Focal electrical stimulation in the pretectal Thalamus evokes avoidance or escape behaviors in the absence of adequate visual stimuli.Focal stimulation in the pretectal thalamus causes avoidance and escape behaviors in the absence of adequate visual stimuli [31]. __________ Der praetectale Thalamus enthält Neuronentypen, die vorzugsweise auf großflächige visuelle Objekte oder solche mit Querausdehnung antworten, die bei der Kröte Vermeidung bzw. Flucht auslösen [29] [30] . Fokale elektrische Erregung im praetectalen Thalamus bewirkt Fluchtverhalten in Abwesenheit adäquater visueller Stimuli [31] . 9) Pretectal influences Tectal excitation would spread snowballing across the tectal network if there were no inhibitory extrinsic (and intrinsic) influences, e.g., by pretectal thalamic structures. If pretectal inhibitory influences are missing in the tectum, then tectal (intrinsic) excitability will outweigh and the figural prey selectivity is abolished, both in the responses of tectal neurons and in prey-catching behavior [32] [33] [34] [35] (see Figs. 2 bottom and 7). The responses are "disinhibited". Each moving object signals prey. Escape behavior is abolished.
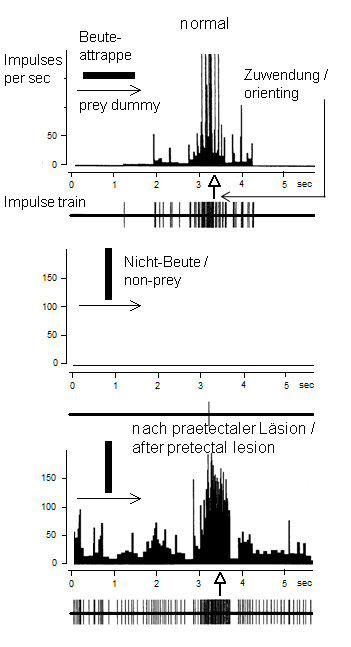
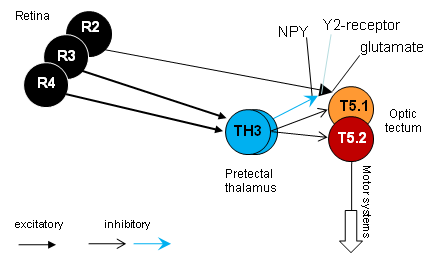
Fig.2. The figure shows the impulse-frequency-time histogram as well as the corresponding impulse train of a prey-selective tectal neuron and the onset (cf. arrow) of behavior (orienting) in a freely moving toad toward prey and non-prey, respectively, prior to and after an ipsilateral pretectal lesion [34] . The records are from the same neuron. Abb.2. Die Abbildung zeigt das Impulsfrequenz-Zeit-Histogramm sowie die entsprechende Impulsfolge eines beuteselektiven Tectumneurons und das Verhalten (Zuwendung) der freibeweglichen Kröte gegenüber Beute bzw. Nicht-Beute, vor und nach einer gleichseitigen Praetectum-Läsion [34] . Es handelt sich hierbei um dasselbe abgeleitete Neuron. Various pretectal thalamic structures (P, Lpd, Lpv, Ptn) are involved in different functions. One form of pretecto-tectal inhibition is mediated by neuropeptide Y (NPY) as a neurotransmitter [23] [24] [25] [26] [27] , produced in pretectal thalamic cells (types TH3 and/or TH4). This suggests pretectal presynaptic inhibition of retino-tectal glutaminergic transfer by NPY via Y2 receptors located at retinal axonal terminals in the tectum (Fig.3). Actually, it was shown that spikes recorded from retinal terminals (e.g., class R2) were attenuated under the influence of NPY [63]. Suggested mechanism: NPY-Y2 triggers in the retinal axonal terminal a signal transduction that induces an increase in K+ efflux that leads to an attenuation in the amplitudes of presynaptically arriving action potentials which in turn reduces Ca++ influx, hence reducing glutaminergic transmitter release. In addition, inhibitory postsynaptic and polysynaptic pretectal inputs were described in the tectum [28] which, for example, is consistent with GABAergic inhibitory processes (cf. also Fig.7).
Fig.3. Hypothesis: pretectal NPY released in the tectum causes presynaptic inhibition of retino-tectal glutaminergic transmission. R2, R3, R4 retinal ganglion cells (R2 weakly, R3 and R4 strongly myelinated axons); TH3, pretectal thalamic cells; T5.1, T5.2, tectal intermediate size-sensitive and prey-selective cells, respectively. -- Furthermore, postsynaptic inhibitory pretecto-tectal connections are considered. Abb.3. Hypothese: praetectales NPY bewikt im Tectum opticum präsynaptische Hemmung des retino-tectalen glutaminergen Transfers. R2, R3, retinale Ganglienzellen (R2 schwach, R3 und R4 stark myelinisierte Axone); TH3, praetectale thalamische Neurone; T5.1, T5.2, Zwischengrößen-sensitive und Beute-selektive Neurone desTectum opticum. -- Darüber hinaus werden postsynaptisch hemmende praetecto-tectale Verbindungen berücksichtigt. _________ Tectale Erregung würde sich lawinenartig über das tectale Netzwerk ausbreiten, wenn es nicht extrinsische und (intrinsische) hemmende Einflüsse gäbe, z.B. durch praetectale thalamische Strukturen. Fehlen im Tectum hemmende praetectale Einflüsse, dann überwiegt tectale (intrinsische) Erregbarkeit, und die Beuteselektivität ist aufgehoben sowohl in den Antworten tectaler Neurone als auch im Beutefangverhalten [32] [33] [34] [35] (s. Abb.2 unten u. 7). Die Antworten sind „enthemmt“. Jedes bewegte Objekt aktiviert Beutefang. Fluchtverhalten fällt aus. Die strukturelle Gliederung des praetectalen Thalamus (P, Lpd, Lpv, Ptn) ist mit unterschiedlichen Funktionen verknüpft. Eine Form praetecto-tectaler Hemmung wird vermittelt durch Neuropeptid Y (NPY) als Neurotransmitter [23] [24] [25] [26] [27] , produziert in praetectal thalamischen Zellen (Typen TH3 und/oder TH4). Hierbei könnte praetectale praesynaptische Hemmung des glutaminergen retino-tectalen Erregungstransfers durch NPY via Y2-Rezeptoren an retinalen Axonterminalen im Tectum eine Rolle spielen (Abb.3). Dafür spricht der Befund, wonach die Amplituden der von retinalen Axonterminalen (z.B. Klasse R2) abgeleiteten Aktionspotenziale unter dem Einfluss von NPY signifikant reduziert sind [63] . Möglicher Wirkungsmechanismus: NPY-Y2 triggert in der retinalen Axonterminalen eine Signaltransduktion, die den K+ Ausstrom erhöht, dadurch die Amplituden der präsynaptisch einlaufenden Aktionspotenziale reduziert, wodurch der Ca++ Einstrom verringert und somit die synaptische Glutamatausschüttung vermindert wird. Darüber hinaus wurden postsynaptisch und di/-polysynaptisch hemmende praetectale Eingänge im Tectum nachgewiesen [28] , die z.B. auf GABAerge Prozesse hinweisen (s. auch Abb.7). 10) Pretectal functions Pretectal thalamic nuclei are involved, e.g.; in:
11) Telencephalic control of pretectum What controls the pretectal thalamus? The telencephalic caudal ventral striatum influences [36] the visual responsiveness (attention) in the tectum, for example, by inhibition of pretectal thalamus [37] [38] (Fig.4). Various experiments support this hypothesis. Ocassionally, a toad is not attentive and thus not responsive to a prey object. In such a case, focal electro-stimulation in the caudal ventral striatum facilitates the toad's response toward prey. Striatal stimulation in the absence of a visual prey stimulus does not release prey-catching behavior. If – following striatal lesions – striatal influences are absent in the pretectum, then pretectal inhibition in the tectum will outweigh, and the toad ignores prey. __________ Wer kontrolliert das Praetectum? Das telencephale caudale ventrale Striatum [36] beeinflusst das Tectum opticum, indem es z.B. – durch Hemmung im praetectalen Thalamus [37] [38] – die visuelle Ansprechbarkeit im Tectum erhöht (Abb.4). Verschiedene Experimente stützen diese Hypothese. Gelegentlich ist eine Kröte unaufmerksam, d.h. nicht bereit, Beute zu fangen. Wird in einem solchen Fall das caudale ventrale Striatum fokal elektrisch stimuliert, antwortet die Kröte auf den visuellen Beutereiz. Elektrostimulation des Striatum ohne visuellen Beutereiz löst kein Beutefangverhalten aus. Fehlen Einflüsse aus dem Striatum, z.B. nach dessen Läsion, dann überwiegt praetectale Hemmung im Tectum, und die Kröte ignoriert Beute.
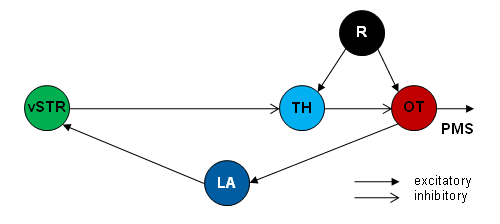
Fig.4. The caudal part of the telencephalic ventral striatum (vSTR) is suggested to be involved in gating an orienting response towards prey, thus enhancing visual attention. Working hypothesis [44] : the retina (R) feeds in parallel to the pretectal caudal thalamus (TH) and the optic tectum (OT); the vSTR obtaines input of OT via the lateral anterior thalamic nucleus (LA) and in turn fascilitates visual responses in OT via a disinhibitory connection vSTR_TH_OT. PMS, premotor/motor systems. 12) Learning Associative learning investigated in the "hand-feeding paradigm" impairs the species-specific figural prey selectivity [10] [11] [35]. If a brain structure involved in learning (Fig.5) – the telencephalic posterior ventromedial pallium (homologous to the hippocampus, "primodium hippocampi") [12] – is inactivated, the learned properties are abolished, and the species-specific prey selectivity will emerge again [13]. Furthermore, there is the phenomenon of stimulus-specific habituation – non-associative learning – that allows toads to distinguish worm-like objects. For example, if a worm-like object A is repetitively presented to the toad, its efficacy in releasing prey-catching declines to zero. Immediately thereafter, a differently cued worm-like object B of the same dimension may elicit full prey-catching activity [75] [76].
(Depending on the object’s cue, B offered following habituation to A and A offered after habituation to B, respectively, may function as a „dishabituating“ stimulus, – or only B offered to A or just A offered to B.) In this kind of learning process, too, the ventromedial pallium participates significantly [77] [78]. Hence, there are stimulus-response mediating pathways involving retino-tectal, retino-pretectal, pretecto-tectal, and tecto-medullary/spinal processing streams. Furthermore, there are modulatory loops involving telencephalic striatal or pallial structures that adjust, modify or specify stimulus-response mediation [35]. __________ Assoziatives Lernen, untersucht im sog. "Handfütterungs-Paradigma", hebt die spezies-spezifische figurale Beuteselektivität auf [10] [11] [35]. Wird im Anschluss eine an Lernprozessen beteiligte telencephale Hirnstruktur (Abb.5) – das posteriore ventromediale Pallium (homolog dem Hippocampus "Primordium hippocampi") [12] – inaktiviert, so erlischt das Gelernte, und die spezies-spezifische Beuteselektivität kommt wieder zur Geltung [13] . Darüber hinaus gibt es das Phänomen stimulus-spezifischer Habituation – nicht-assoziatives Lernen – ,das es Kröten ermöglicht, zwischen wurmähnlichen Objekten zu unterscheiden. Wenn einer Kröte z.B. ein wurmähnliches Objekt A wiederholt geboten wird, sinkt dessen Auslösewirkung auf null. Unmittelbar im Anschluss löst ein anders gezeichnetes wurmförmiges Objekt B gleicher Dimension die volle Beutefangaktivität aus [75] [76]. (Je nach Zeichnung des Objekts kann B nach A geboten und A nach B geboten als „dishabituierender“ Stimulus wirken, oder nur B nach A bzw. nur A nach B geboten.) Bei diesen Lernprozessen spielt ebenfalls das ventromediale Pallium eine wichtige Rolle [77] [78]. Demnach gibt es Reiz-Reaktion vermittelnde Bahnen, an denen retino-tectale, retino-praetectale, praetecto-tectale und tecto-bulbar/spinale Verarbeitungsströme beteiligt sind. Darüber hinaus bestehen modulatorische Schleifen unter Beteiligung des telencephalen Striatum bzw. Pallium, welche die Reiz-Reaktions-Vermittlung justieren, modifizieren oder spezifizieren [35].
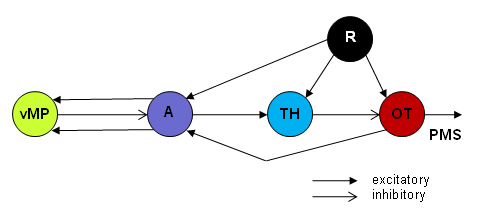
Fig.5. During hand-feeding conditioning in toads, the posterior part of the telencephalic ventral medial pallium (vMP) is suggested to be involved in modifying (impairing) the prey selectivity. Working hypothesis [44] : output of the retina (R) feeds in parallel to optic tectum (OT), pretectal caudal thalamus (TH), and anterior thalamus (A); the vMP obtaines concurrent (contigent) input of A related to the prey stimulus and to the hand stimulus, respectively. As a result, certain vMP neurons are sensitized and – via a disinhibitory connection vMP_A_TH_OT – fascilitate (disinhibit) tectal prey-catching related responses towards prey, non-prey or predator-like stimuli. PMS, premotor/motor systems. Abb.5. Im Verlauf einer Handfütterungs-Konditionierung der Kröte ist der posteriore Abschnitt des telencephalen ventralen medialen Pallium (vMP) daran beteiligt, die Beuteselektivität zu modifizieren (aufzuheben). Arbeitshypothese [44] : parallele Ausgänge der Retina (R) speisen das Tectum opticum (OT), den praetectalen caudalen Thalamus und den anterioren Thalamus (A); das vMP erhält gleichzeitige (kontigente) Eingänge bezogen auf den Beute-Stimulus und den Hand-Stimulus. Daraufhin werden bestimmte vMP-Neurone sensitiviert, und diese können – über eine disinhibitorische Verknüpfung vMP_A_TH_OT – tectale beutefangbezogene Antworten auf Beute, Nicht-Beute oder Feind-Stimuli fördern (enthemmen). PMS, Praemotor/motor-Systeme. 13) Conserved connections The species-specificity of figural prey detection may be considered under the following aspects. If the ratio of longitudinal and transverse dimensions of an object are in a certain range, the objects are associated with prey (Fig.1). The limits of the range may fluctuate depending on day time, season, motivation, and learning. Prey-catching also requires attention. Altough these connections are previliged, there is room for plasticity. They can be influenced (adjusted) by weighted input to the corresponding pretectal structure, e.g., in the course of learning processes. -- Following pretectal thalamic lesions, the time course and accuracy of functional recovery of prey selectivity depend on the extent of the lesion. __________ Die Spezies-Spezifität der figuralen Beuteerkennung lässt sich unter folgenden Teilaspekten betrachten. Wenn das Verhältnis der Längs- und Querausdehnungen eines Objekts in einem bestimmten Bereich liegen, signalisiert das Objekt ''Beute'' ( Abb. 1). Die Grenzen jenes Bereichs unterliegen Schwankungen, die von Tageszeit, Jahreszeit, Motivation und Lernprozessen abhängig sind. Die Beutefangreaktion setzt Aufmerksamkeit voraus. Es ist denkbar, dass im Laufe der Evolution Objekte mit betonter Querausdehnung – in praetectalen Strukturen analysiert – sich als unvorteilhaft erwiesen haben. Mithin wurde diese wichtige Information (Überlebensfaktor) festgelegt und evolutionär konserviert in praetecto-tectalen inhibitorischen Verknüpfungen (struktureller Aspekt) und deren Synapsen begründet (funktioneller Aspekt). Obgleich diese Verknüpfungen vorberechtigt sind, besteht Plastizität. Durch gewichtete Beeinflussung entsprechender praetectaler Strukturen sind sie justierbar, zum Beispiel im Verlauf von Lernprozessen. -- Nach praetectalen Läsionen sind Zeitverlauf und Grad der funktionellen Restitution der Beuteselektivität vom Ausmaß der Läsion abhängig. 14) Releasing mechanism / system Prey-selective tectal neurons are processing visual information, on the one side, and are sending the result along their axons to motor structures of the medulla oblongata [39] [40] [41] [42] , on the other side. The responses of these feature detectors are addressed to corresponding motor pattern generating systems. Actually, it was shown with neuroanatomic HRP-backfilling techniques [39] and with neurophysiologic back-firing methods [40] that prey-selective cells from the snapping evoking area of the optic tectum project their axons toward the motoneuronal pools of the jaw and tongue muscles, the effectors involved in the tongue flip of the snap. In combination with other types of feature-sensitive neurons descending to the motor systems, prey-selective neurons form a sensorimotor interface [43] as a basis of releasing systems [44] of the adequate prey-catching response (concept of sensori-motor codes). Probably not one neuron, rather a small population of neurons of the same type are involved in releasing systems. For example, the localization of a visual stimulus in the x-y coordinates takes advantage of the retinal topography by T5-type neurons whose excitatory receptive fields, however, have a diameter of about 25 deg. visual angle. The accuracy of localization may result from a population of adjacent neurons whose receptive fields partly overlap (common intersect).
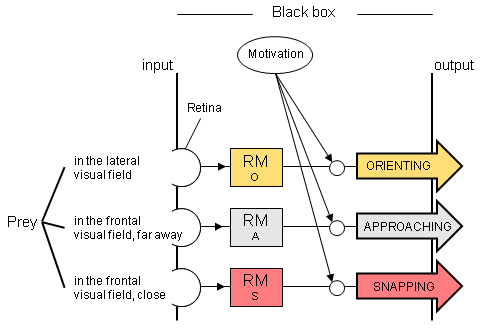
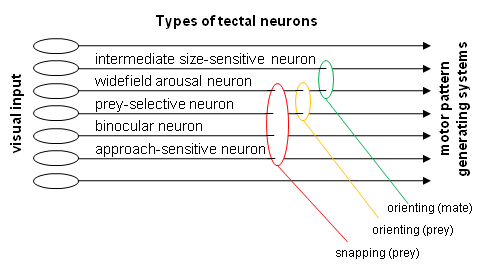
Above: Black box suggesting different releasing mechanisms (RM) of different prey-catching responses. Below: Examples of different types of tectal neurons suitable to be involved in the implementation of a RM.
Fig.6. Various types of visual neurons of the optic tectum project their axons toward the medullary/spinal premotor/motor structures (motor pattern generating systems). The concept of sensorimotor codes [44] suggests that adequately activated types of neurons in a certain combination drive the corresponding motor response. Motivational inputs (e.g., related to feeding, mating, etc) influence the neurons and/or the motor systems. Examples; Intermediate size-sensitive neurons: type T5.1; widefield arousal neurons: type T4; prey-selective neurons: type T5.2; binocular smallfield neurons: type T1.3; approach-sensitive smallfield neurons: type T3. Hypothetical tegmental neurons -- computing retinal topography and body segment orientation -- must be considered, too, especially for orienting responses. Abb.6. Verschiedene Neuronentypen des Tectum opticum projizieren ihre Axone zu den medullären/spinalen Praemotor/motor-Strukturen (motorische Muster generierende Systeme). Das Konzept der Sensomotorischen Codes besagt, dass adäquat aktivierte Neuronentypen in bestimmter Kombination die zugeordnete motorische Reaktion auslösen. Eingänge der Motivationssysteme (z.B. bezogen auf Nahrungserwerb, Paarung) beeinflussen die Neurone und/oder die Motorsysteme. Zwischengrößen-sensitive Neurone: Typ T5.1; Arousal Großfeld-Neurone: Typ T4; Beute-selektive Neurone: Typ T5.2; binokulare Kleinfeld-Neurone: Typ T1.3; Annäherung-sensitive Kleinfeld-Neurone: T3. Hypothetische Neurone des Tegmentum -- die retinale Topography und Körpersegment-Position verrechnen -- müssen zusätzlich berücksichtigt werden, vor allem für orientierende Zuwendungen.
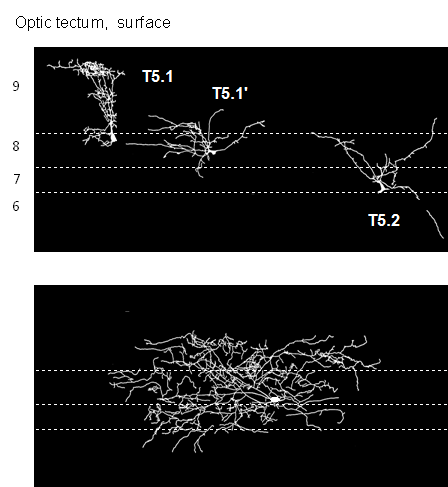
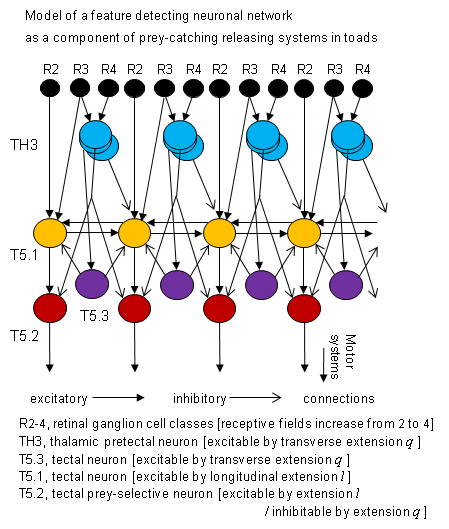
Examples of reconstructions of tectal cells intracellularly recorded and stained with the cobalt-lysine technique[16] : intermediate size-sensitive (type T5.1, T5.1') and prey-selective (type T5.2) neurons; in the T5.2 cell the axon could be traced towards the medulla oblongata. Below: large field aurousal neuron (type T4) whose receptive field extended into the whole field of vision. In other studies [40] the extracellularly recorded tectal neurons could be antidromically backfired in response to electrical stimuli applied to the medulla oblongata (evidence of their tecto-medullary descending axons; criterion: collision-test). ________ Beuteselektive Neurone des Tectum verarbeiten einerseits visuelle Informationen und leiten andererseits das Ergebnis entlang ihrer Axone zu motorischen Strukturen der Medulla oblongata [39] [40] [41] [42] . Die Antworten dieser Merkmals-Detektoren sind an korrespondierende Motorische System adressiert. Es konnte mit neuroanatomischen retrograden HRP-Markierungsmethoden [39] und mit neurophysiologischen antidromen Aktivierungstechniken [40] gezeigt werden, dass beuteselektive Neurone aus der Schnapp-evozierenden Area des Tectum opticum zu den motoneuronalen Pools der Kiefer- und Zungenmuskulatur projizieren, also jener Effektoren, die am Zungenschlag der Schnappreaktion beteiligt sind. In Kombination mit anderen, zu den motorischen Zentren führenden Neuronentypen bilden Beute-selektive Neurone ein sensomotorisches Interface [43] und damit eine Grundlage für Auslösesysteme [44] der adäquaten Beutefangmotorik (Konzept des Sensomotorischen Code). Mithin ist ein Auslösemechanismus ein sensomotorisches Interface, das – wie der Janus-Kopf – in zwei Richtungen blickt, zur Sensorik und zur Motorik. Er dient einerseits der Signal-Erkennung sowie der Signal-Ortung in den x-y-z Raumkoordinaten und andererseits der Ansteuerung der adäquaten motorischen Reaktion (Zuwendung zur Beute, Annäherung an die Beute bzw. Schnappen der Beute). Die Wahl der Fangmotorik setzt Beuteerkennung voraus und wird durch die Ortsposition des Signals mitbestimmt. Vermutlich ist nicht jeweils ein Neuron, sondern eine kleine Population von Neuronen des gleichen Typs an Auslösesystemen beteiligt. Zum Beispiel bedient sich die Lokalisation eines visuellen Stimulus in den x-y Koordinaten der retinalen Topographie von T5-Typ Neuronen, deren erregende rezeptive Felder jedoch einen Durchmesser von ca. 25 grad Sehwinkel haben. Die Genauigkeit der Lokalisierung könnte durch eine Population benachbarter Neurone mit teilweise überlappenden rezeptiven Feldern (gemeinsame Schnittmenge) erreicht werden. 15) Triggering prey-catching Prey-selective tectal neurons show specific firing patterns just before the toad turns toward prey (Fig.2 top) and snaps at it [45] , respectively (see Fig.2). Focal electrical stimulation in the tectum close to prey selective neurons causes prey-catching behavior, such as orienting and snapping, respectively, according to the retino-tectal topography [46] [47]. Consequently, snapping is elicited from the representation of the visual snapping zone, called "snapping evoking area". __________ Beuteselektive Tectumneurone zeigen bestimmte Entladungsmuster kurz bevor sich die Köte der Beute zuwendet (Abb.2 oben) bzw. zuschnappt [45] . Fokale elektrische Erregung des Tectum im Bereich Beute-selektiver Neurone löst Beutefang aus, wie z.B. orientierende Zuwendung und Zuschnappen gemäß der retinot-tectalen Topographie [46] [47] . Schnappreaktionen lassen sich dementsprechend von einem Bereich des Tectum auslösen, der die visuelle Schnappzone repräsentiert ("Schnappen evozierende Area"). 16) Background texture The structure / texture of the background (for example, visual noise according to Julesz) has significant influence on movement perception in the toad: A stationary structured background facilitates the extraction of a moving prey object in both the prey-catching behavior [69] and the responses of prey-selective tectal neurons (type T5.2) [70] . __________ Ein stationärer strukturierter Hintergrund fördert die Extraktion eines bewegten Beuteobjekts sowohl im Beutefangverhalten [69] als auch in der Antwort beuteselektiver tectaler Neurone (Typ T5.2) [70] . 17) Size constancy phenomenon As in the prey-catching behavior [48] [49], tectal neurons recorded in freely moving toads are sensitive to the absolute size of a moving object at variable distance between toad and object, within limits [50] . This size constancy phenomenon is not restricted to binocular vision. Monocular criteria for the required depth perception are motion parallax, triangulation [51], lens accommodation. __________ Ähnlich wie im Beutefangverhalten [48] [49] sind Tectumneurone freibeweglicher Kröten für die absolute Größe eines bewegten Objekts sensitiv für variable Distanz zwischen Kröte und Objekt, in Grenzen [50] . Dieses Größenkonstanz-Phänomen ist nicht an binokulares Sehen gebunden. Monokulare Kriterien für die erforderliche Tiefenwahrnehmung sind Bewegungsparallaxe, Triangulation [51] , Linsen-Akkommodation. . 18) Integration of vision and touch Neurons showing both visual input and somatosensory input of the body skin were recorded in the optic tectum, subtectum [79], caudal thalamus [80], caudal ventral striatum [81] and in the medulla oblongata [82] . The most common are: a) neurons responding to moving visual stimuli from the entire visual field of the contralateral eye and to tactile stimuli from the entire contralateral body skin; b) neurons which cover the whole visual field of both eyes and both sides of the body skin. This suggests a tremendous convergence of different inputs. The interplay between visual and tactile inputs could be investigated in two types of neurons recorded from the caudal thalamus [80]. In both cases, tactile stimulation sensitized the neuron’s response to a subsequent visual stimulus: Type TH5.3 shows a response characteristic like (a). Due to tactile stimulation of the body skin the visual receptive field extends out to the entire field of vision of both eyes. Type TH10 responds toward a large stationary visual object (obstacle) for a few seconds. After tactile stimulation of the body skin, the neuron starts responding to the stationary obstacle again. Such neurons might serve a kind of expectation. Physical contact alerts the toad’s visual attention. __________ Neurone, die sowohl visuelle als auch somatosensorische Eingänge der Körperhaut haben, wurden bei Kröten im Tectum opticum, Subtectum [79], caudalen Thalamus [80], caudalen ventralen Striatum [81] und in der Medulla oblongata [82] nachgewiesen. Am weitesten verbreitet sind: a) Neurone, die auf bewegte visuelle Stimuli aus dem gesamten Gesichtsfeld des kontralateralen Auges sowie auf taktile Stimuli aus der Körperhaut der kontralateralen Körperseite ansprechen; b) Neurone, die – wie oben – jedoch das ganze Gesichtsfeld beider Augen und der ganzen beidseitigen Körperhaut erfassen. Dies lässt weist auf enorme Konvergenz verschiedener Eingänge hin. Das Zusammenspiel zwischen visuellen und taktilen Eingängen konnte bei zwei Neuronentypen aus dem caudalen Thalamus näher untersucht werden [80]. In beiden Fällen sensibilisiert taktile Stimulation die neuronale Antwort auf einen anschließenden visuellen Stimulus: Typ TH5.3 zeigt eine Reaktionscharakteristik wie (a). Aufgrund taktiler Stimulation breitet sich das visuelle rezeptive Feld auf das gesamte Gesichtsfeld beider Augen aus. Typ TH10 antwortet kurzfristig auf ein großes stationäres Objekt (Hindernis). Nach taktiler Reizung der Körperhaut setzt die Antwort auf das stationäre visuelle Hindernis wieder ein und hält eine Zeitlang an. Solche Neurone könnten einer Art Erwartungshaltung dienen. Körperberührung alarmiert die visuelle Aufmerksamkeit der Kröte. 19) Implicit vs. explicit feature computation Prey-selective tectal neurons of the toad are characterized by an implicit feature detection. For example, the discrimination between a bar moving in the direction of its longitudinal axis and the bar oriented transversely to the direction of movement is implicit for each movement direction in the x-y coordinates. The visual field (receptive field) of the neuron, however, has an approximately radially symmetric shape. The required asymmetry for this discrimination lies in the different spatial-temporal characteristics of both features (longitudital vs. transverse dimensions) and the underlying neuronal processing. Implicit feature detection demands just one type of neurons and a few neurons per visual field section. __________ Beuteselektive Tectumneurone der Kröte zeichnen sich durch implizite Merkmalserfassung aus. Die Erfassung der Objektausdehnungen – längs gegenüber quer – ist implizit für jede Bewegungsrichtung in den x-y Raumkoordinaten, wobei der Gesichtsfeldausschnitt (rezeptives Feld) eines beuteselektiven Neurons eine annähernd radiärsymmetrische Form hat. Die Asymmetrie liegt in den unterschiedlichen räumlich-zeitlichen Eigenschaften beider Konfigurationen (Längs-bzw. Querausdehnung) und den zugeordneten neuronalen Verarbeitungsprozessen. Für implizite Merkmalserfasssung ist prinzipiell nur ein Neuronentyp, und es sind relativ wenige Neurone pro Gesichtsfeldbereich erforderlich. Es bietet sich ein Vergleich mit expliziter Merkmalserfassung an. Hierfür sind beim Affen sog. Simple Cells des primären visuellen Cortex geeignet, deren längliches asymmetrisches rezeptives Feld zu der jeweiligen Ausrichtung eines schmalen Objekts passt. Für explizite Erfassung verschiedener Objektausrichtungen ist eine immense Anzahl von entsprechenden Detektoren pro Gesichtsfeldbereich erforderlich. Das implizite Prinzip bei der Kröte ist – mangels eines visuellen Cortex – hinsichtlich der neuralen Verarbeitungsstruktur vergleichsweise sparsam. Der Vorteil expliziter Merkmalserfassung besteht im Partizipieren an verschiedenen, z.T. anspruchsvollen Aufgaben. 20) Phylogenetic aspects Do some basic functions of our brain originate in the toad's brain? For example, the striatum-mediated control of directed attention, the primordium hippocampi-mediated associative and non-associative learning, the NPY-mediated modulation of visual processes, are such basic properties that emerged during evolution in early tetrapods in homologous brain structures and that have been preserved during evolution in order to differentiate among the amniotes up to the mammalia in species-specific expression. Homologous structures and pathways involved in innate visual object recognition (e.g., optic tectum/superior colliculus, nucleus of the optic tract, anterior and posterior pretectal nuclei, nucleus of the posterior commissure) are compared in amphibian, avian, rodent and primate species [61]. _________ Haben einige grundlegende Funktionen unseres Gehirns ihren Ursprung im Krötenhirn? Bei der Striatum-vermittelten Kontrolle der gerichteten Aufmerksamkeit, bei dem primordium hippocampi-vermittelten assoziativen sowie nicht-assoziativen Lernen und bei der Neuropeptid Y-vermittelten Modulation visueller Prozesse handelt es sich um grundlegende Eigenschaften, die bei Tetrapoden stammesgeschichtlich früh hervorgetreten und in homologen Hirnstrukturen während der Evolution konserviert worden sind, um sich bei den Amnioten bis hin zu den Mammalia in artspezifischer Ausprägung zu differenzieren. Kürzlich wurden homologe Strukturen und Verbindungswege (u.a. Tectum opticum/Colliculus superior, Nucleus des Tractus opticus, anteriore and posteriore praetectale Nuclei, Nucleus der posterioren Kommissur) untersucht, die an der angeborenen visuellen Merkmalserkennung bei Amphibien, Vögeln, Nagetieren und Primaten beteiligt sind [61]. Betrachtet man beispielsweise die inhibitorische Wirkung von praetectalem Neuropeptid Y auf das Tectum der Anuren (Amphibia): NPY hemmt – vermutlich durch Y2-Rezeptoren vermittelt – den retino-tectalen Transfer und beeinträchtigt folglich die Auslösewirkung eines visuellen Beute-Stimulus (vgl. auch [62]). Dieser Effekt ist sowohl bei der Rotbauchunke Bombina orientalis (Discoglossidae: erste fossile Funde Jura) als auch bei der Erdkröte Bufo bufo (Bufonidae: erste fossile Funde Paläozän, Danium) nachgewiesen worden. In geologischen Epochen beträgt der Abstand des Auftretens jener Anuren-Familien schätzungsweise 65 Mio Jahre. Unter den Amnioten wurden NPY-haltige Praetectum-Neurone bei Schildkröten (Reptilia), Tauben (Aves) sowie Ratten und Menschen (Mammalia) gefunden [52] . . 21) Modeling and neural engineering Modeling of central nervous processes that underlie the distinction of moving objects in toads was performed in contact with Werner von Seelen [53] , Francisco Cervantes-Pérez . [54] [55] Michael A. Arbib [56] [57] [58], and Ann Reddipogu [59] . Figure 7 suggests a neuronal network providing the algorithm that reveals the toad‘s prey category by weighting critical feature components – extensions l and q (cf. Fig.1) – and comparing with non-prey cues. The proposed pattern of connections of retinal ganglion cells (R2-4), tectal (T5.1, T5.2) and pretectal thalamic (TH3) neurons considers various experimental data, such as:
Fig.7. Model of a neuronal network discriminating figural features, l and q, of moving objects. Principle after Ewert 1974 [47]. In short: the response property of toad's prey-selective T5.2 neurons is determined by excitatory input from T5.1 neurons and inhibitory input from TH3 neurons. The response property of predator-sensitive TH4 neurons (not shown in this diagram) is determined by excitatory inputs both from TH3 and T5.1 neurons. Abb.7. Modell eines neuronalen Netzwerks für die Unterscheidung figuraler Merkmale l und q bewegter Objekte. Prinzip nach Ewert 1974 [47]. Kurz: Die Antwortcharakteristik von Beute-selektiven T5.2 Neuronen der Kröte wird bestimmt durch erregende Eingänge von T5.1 Neuronen und hemmende Eingänge von TH3 Neuronen. Die Antwortcharakteristik von Feind-sensitiven TH4 Neuronen (nicht gezeigt in diesem Diagramm) wird bestimmt durch erregende Eingänge von TH3 und T5.1 Neuronen. Artificial neuronal networks, implementing principles of toad vision, found application in the experimental platform "sorting conveyor moving objects with a robotic manipulator" [60] (see BMBF Verbundprojekt SEKON). __________ Zur Modellierung zentralnervöser Prozesse, die der Unterscheidung bewegter Objekte bei Kröten zugrundeliegen, vgl. Werner von Seelen [53] , Francisco Cervantes-Pérez [54] [55] , Michael Arbib [56] [57] [58] , Ann Reddipogu [59] . Abbildung 7 zeigt ein neuronales Netzwerk, das vermutlich dem Algorithmus zugrunde liegt, der durch Abwägung kritischer Merkmalskomponenten bewegter Objekte – Ausdehnungen l und q (vgl. Abb.1) – die figurale Beute-Kategorie der Kröte erschließt und von Nicht-Beute abgrenzt. Das vorgeschlagene Verbindungsmuster zwischen retinalen Ganglienzellen (R2-4), tectalen (T5.1, T5.2) und praetectal thalamischen (TH3) Neuronen berücksichtigt u.a. folgende experimentelle Daten:
Künstliche neuronale Netze, die Prinzipien des Kröten-Modells implementieren, fanden Anwendung in der Experimentierplattform "Sortieren Förderband-bewegter Objekte mit Robotergreifarm" [60] (s. BMBF-Verbundprojekt SEKON). . 22) Historical background Concepts of feature-selective neurons in frogs and toads
.
This means that the different classes of retinal ganglion cells already transmit parcels of important preprocessed information to the brain. The analysis and recognition of behaviorally relevant visual features, however, proceed in retinorecipient neuronal populations. Downstream the retina, Grüsser and Grüsser-Cornehls recorded in the optic tectum different types of visually sensitive neurons, some types showing complex response properties, some even exhibiting visual and somatosensory input from the body skin. However, they did not find neurons with response properties suitable for prey recognition. Hence the statement by
.
The discovery of prey-selective neurons resulted from the choice of the experimental animal – common toad Bufo bufo [cf. 4)] – and the comparison of feature-activity-curves obtained in prey-catching with the corresponding ones obtained in retinal ganglion cells and retinorecipient pretectal neurons and tectal neurons. The recordings in freely moving toads also showed that tectal neurons – in contrast to retinal ganglion cells – were sensitive to the absolute size of a moving object by estimating its distance. In other words, as in prey-catching behavior, they exhibited a size constancy phenomenon. In pharmacologically paralyzed toads, however, both retinal ganglion cells and tectal neurons were sensitive to the visual anglular size, largely regardless of the object‘s distance to the animal.
Anhand von detaillierten quantitativen Analysen der Antwort-Charakteristika der vier retinalen Ganglienzell-Klassen widerlegten Grüsser und Grüsser-Cornehls die Hypothese, dass jeweils eine Klasse retinaler Ganglienzellen als Fliegen- bzw. Käfer-Detektor fungiert. Vielmehr fanden
Das bedeutet, dass die verschiedenen Klassen retinaler Ganglienzellen dem Amphibienhirn bereits wichtige vorverarbeitete Informationen verpackt zuführen. Die Analyse eines visuellen Merkmals und dessen Zuordnung zu einer Bedeutung erfolgt jedoch in Neuronenpopulationen, die der Retina nachgeschaltet sind. In dem der Retina nachgeschalteten Tectum opticum registrierten Grüsser und Grüsser-Cornehls verschiedene, z.T. komplexe visuell erregbare Neuronentypen, teilweise mit visuellen und somatosensorischen Eingängen von der Körperhaut. Allerdings fanden sie keine Neurone, deren Antworten für visuelle Beute-Erkennung infrage kamen. Daraus folgerten
Die von Grüsser und Grüsser-Cornehls aufgestellte Hypothese besagt, dass der Frosch nicht erkennt, was er sieht, bevor er reagiert. Der Annahme, dass Frösche oder Kröten die Beutefangverhaltenssequenz (Zuwendung zur Beute, Annäherung und Zuschnappen) „in toto“ durchlaufen haben müssen, um Beute zu erkennen, widersprechen quantitative Verhaltensanalysen. Bereits die Zuwendung zur Beute setzt Beuteerkennung voraus. Folglich besteht Übereinstimmung in den Merkmal-Aktivität-Kennlinien für die Zuwendereaktion zur Beute mit denen für die Schnappreaktion. Entsprechend antworten die von Ewert und Mitarbeitern im Tectum opticum der Kröte entdeckten Beute-selektiven Neurone auf Beuteobjekte mit praemotorischen Entladungsmustern (s. Fig.2 oben). So berichten
Die Entdeckung Beute-selektiver Neurone beruht auf der Wahl des Versuchstiers – Erdkröte Bufo bufo [cf. 4)] – und auf dem Vergleich der für den Beutefang ermittelten Merkmal-Reaktion-Kennlinien mit entsprechenden Kennlinien für retinale Ganglienzellen sowie retinarezipiente praetectale und tectale Neurone. Die Ableitungen von Neuronen an freibeweglichen Kröten zeigten zudem, dass Tectumneurone, im Gegensatz zu retinalen Ganglienzellen, die absolute Größe eines bewegten Objekts unter Abschätzung dessen Entfernung bewerten, also – wie im Beutefangverhalten – ein Größenkonstanz Phänomen aufweisen. In pharmakologisch paralysierten Kröten dagegen bewerten Tectumneurone und retinale Ganglienzellen die Sehwinkelgröße eines Objekts weitgehend unabhängig von dessen Entfernung. Prey-selective neurons of the toad respond preferably to a category of objects resembling potential prey (cf. Fig.1). Not one prey-selective neuron is probably sufficient to elicit prey capture. Prey-selective neurons can be regarded as significant components of a prey detecting system. Experience, recognition, and motivation-depending evaluation take place in conjunction with brain structures that are homologous to the limbic complex of amniotes (Ewert 1997). The response characteristic of prey-selective neurons results from retino-tectal and retino-pretectal parallel processing streams which are computing the significant configural object features l and q, respectively. Both features are related to each other through convergence of both processing streams. Since the introductive fife questions gave positive answers, species-specific prey-recognition by the common toad in the present case study is a matter of converging information processing of initially distributed processing streams (cf. „convergence concept“). There is a coded linkage from perception to reaction (cf. concept of „sensorimotor codes“ (Ewert 1997). The hypothesis put forward by Grüsser and Grüsser-Cornehls originates in the ideas by the American philosopher and psychologist William James (1842-1910), today called the „common coding theory“. It claims: (1a) action is a means to perception, (1b) perception is a means to action, (2) in the brain there is a shared representation for both perception and action, and (3) perception and action are directly linked by a common computational code. If one tries to apply the common coding theory to prey-recognition and prey-catching in toads, the statements (1b) and (3) conform to the experimental data, provided that in (3) the linkage is unidirectional, i.e. from perception to reaction. However, the statements (1a) and (2) are inapplicable. Consequently, the theory of common coding is invalid for this case study. __________ In den 80er und 90er Jahren gelang dann z.B. den englischen Hirnforschern Edmund Rolls und Keith Kendrick der Nachweis einzelner Neurone im inferioren temporalen Cortex von Primaten und von Hochlandschafen, die auf das Gesicht ihres Artgenossen oder ihres Betreuers maximal ansprachen. Mit der Entdeckung „Gesicht-selektiver“ Neurone wurde die Fragwürdigkeit des Großmutter-Neurons relativiert. Mit einem Ensemble von unterschiedlich abgestimmten Gesicht-selektiven Neuronen könnten Gesichter unterschieden bzw. erkannt werden. Erkennung, Erfahrung und emotionale Bewertung erfolgen in Verbindung mit Hirnstrukturen des limbischen Komplexes. Beuteselektive Neurone der Kröte antworten auf eine Kategorie von Objekten (vgl. Abb.1), die in das Beuteschema passen. Vermutlich ist nicht ein Beuteneuron für die Auslösung des Beutefangs ausreichend. Beute-selektive Neurone lassen sich als signifikante Komponenten eines Beuteerkennungssystems auffassen. Erfahrung, Erkennung und motivationsabhängige Bewertung erfolgen in Verbindung dieses Systems mit Hirnstrukturen, die dem limbischen Komplex der Amnioten homolog sind (Ewert 1997). Beute-selektive Neurone verdanken ihre Reaktionscharakteristik retino-tectalen und retino-praetectalen parallelen Verarbeitungsströmen, die die bedeutsamen Objektmerkmale l bzw. q erfassen. Beide Merkmale werden aufeinander bezogen durch Konvergenz der beiden Verarbeitungsströme. Da die anfangs gestellten fünf Fragen positiv beantwortet worden sind, handelt es sich bei der spezies-spezifischen Beuteerkennung der Erdkröte in der vorliegenden Fallstudie um konvergente Informationsverarbeitung von zunächst weitgehend getrennt verlaufenden Verarbeitungsströmen (vgl. „Konvergenz Konzept“). Es besteht eine kodierte Verknüpfung von der Perzeption zur Reaktion (vgl. Konzept der „Sensomotorischen Codes“ (Ewert 1997). Die von Grüsser und Grüsser-Cornehls vorgestellte Hypothese geht zurück auf Ideen des amerikanischen Philosophen und Psychologen William James (1842-1910), heute bekannt als „Common Coding Theorie“. Jene besagt: (1a) das Handeln ist ein Mittel zur Wahrnehmung, (1b) die Wahrnehmung ist ein Mittel zum Handeln, (2) Wahrnehmung und Handlung werden im Gehirn gemeinsam repräsentiert, und (3) Wahrnehmung und Handlung sind durch einen gemeinsamen Verarbeitungs-Code direkt mit einander verknüpft. Versucht man die Common Coding Theorie auf die Beute-Erkennung und die Beutefangreaktionen der Erdkröte anzuwenden, so stehen die Forderungen (1b) und (3) in Übereinstimmung mit den experimentellen Ergebnissen, sofern die Verknüpfung in (3) einseitig gerichtet ist, d.h. von der Perzeption zur Reaktion. Die Forderungen (1a) und (2) treffen allerdings nicht zu. Damit ist die Theorie des Common Coding für diese Fallstudie hinfällig. . References cited / historical background Bullock T.H. (1999) Neuroethology has pregnant agendas. J. Comp. Physiol A 185(4): 291-295 Ewert J.-P. (1997) Neural correlates of key stimulus and releasing mechanism: A case study and two concepts. Trends Neurosci. 20(8): 332-339 Grüsser O.-J., Grüsser-Cornehls U. (1970) Die Neurophysiologie visuell gesteuerter Verhaltensweisen bei Anuren. Verh. Deutsch. Zool. Ges. Köln 64: 201-218 Grüsser O.-J., Grüsser-Cornehls, U. (1976) Neurophysiology of the anuran visual system. In Llinas R., Precht W. (Eds.) Frog Neurobiology. Springer New York, pp.298-385 Kendrick K.M. (1991) How the sheep's brain controls the visual recognition of animals and humans. J. Anim. Sci.69: 5008-5016 Lettvin J.Y., Maturana H.R., McCulloch W.S., Pitts W.H. (1959) What the frog’s eye tells the frog’s brain. Proc. Inst. Radio. Engin. 47: 1940-1951 Rolls E.T.(1984) Neurons in the cortex of the temporal lobe and in the amygdala of the monkey with responses selective for faces. Hum. Neurobiol. 3: 209–22 Spreckelsen C., Schürg-Pfeiffer E., Ewert J.-P. (1995) Responses of retinal and tectal neurons in non-paralyzed toads Bufo bufo and Bufo marinus to the real size versus angular size of objects moved at variable distance. Neurosci. Lett. 184: 105-108 Schürg-Pfeiffer E., Spreckelsen C., Ewert J.-P. (1993) Temporal discharge patterns of tectal and medullary neurons chronically recorded during snapping toward prey in toads Bufo bufo spinosus. J. Comp. Physiol. A 173: 363-376 __________
The erect posture of man: a signal with a threatening significance? Der aufrechte Gang: Signal mit Drohwirkung? __________ . Drittmittelübersicht der Abteilung Neurobiologie/Neuroethologie
. |

 M
M